En medicina, una quemadura es un tipo de lesión en la piel causada por diversos factores. Las quemaduras térmicas se producen por el contacto con llamas, líquidos calientes, superficies calientes y otras fuentes de altas temperaturas; aunque el contacto con elementos a temperaturas extremadamente bajas, también las produce. También existen las quemaduras químicas y quemaduras eléctricas.
Si el evento acaba de suceder y no sabe que hacer, active los servicios de emergencia de su localidad (bomberos, paramédicos, etc). El tratamiento inmediato como medida de primeros auxilios para las quemaduras leves consiste en sumergir el área afectada en agua fresca para enfriar los tejidos quemados.
Tipo de quemaduras por grados
Primer grado
Las quemaduras de primer grado, se limitan a la capa superficial de la piel epidermis, se le puede llamar como eritema o también como epidérmica.
- Dolor al tacto
- La piel se hincha un poco
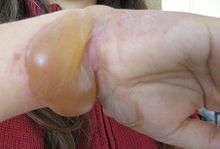
Segundo grado
Las quemaduras de segundo grado traspasan la primera capa de la piel, y dañan la segunda, la dermis. A éstas se las puede llamar como dérmica o flictena.
Signos:
- Fuerte enrojecimiento de la piel
- Dolor
- Apariencia lustrosa por el líquido que supura
- Posible pérdida de parte de la piel
- Hipersensibilidad al aire
- ampolla de agua
Tercer grado
Una quemadura de tercer grado penetra por todo el espesor de la piel, y destruye el tejido. Si se destruyen los folículos pilosebáceos y las glándulas sudoríparas, se compromete la capacidad de regeneración. Se la puede llamar necrosis.
Signos:
- Pérdida de capas de piel
- A menudo la lesión es indolora, porque los nervios quedan inutilizados (puede que el dolor sea producido por áreas de quemaduras de primer grado y segundo grado que a menudo rodean las quemaduras de tercer grado)
- La piel se ve seca y con apariencia de cuero
- La piel puede aparecer chamuscada o con manchas blancas, cafés o negras
- Ruptura de piel con grasa expuesta
- Edema
- Superficie seca
- Necrosis
- Sobreinfección
Causas:
- Fuego
- Exposición prolongada a líquidos calientes
- Contacto con objetos calientes o electricidad
Cuarto grado
Hay daños de músculos y huesos. Suelen presentarse en quemaduras por frío extremo y congelación. Puede desembocar en necrosis y caída de las extremidades (brazos o piernas)
bibliografia:
.wikipedia.org/wiki/Quemadura